EMA症例106:2月症例解説
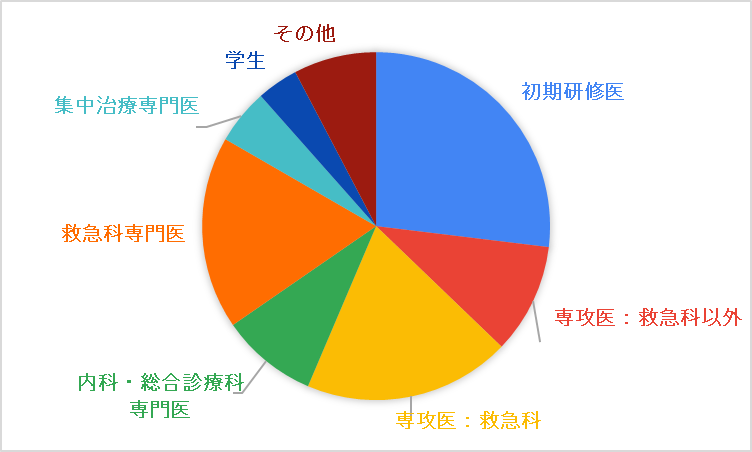
2月の症例に回答してくださった皆様、ありがとうございました。回答は82名で、内訳は以下の通りです。「その他」には精神科専門医、看護師や放射線技師などが含まれ、幅広く参加いただけ嬉しいです。
図1.「問3.あなたの属性は?」の内訳
さて今回は、神経性やせ症(Anorexia nervosa)既往のある患者が、入院後に意識障害・痙攣を生じたため転院搬送されたという症例でした。
神経性やせ症は、神経性食思不振症や神経性無食欲症などとも呼ばれていましたが、DSM-5の日本語版で神経性やせ症に統一されました。若年者の精神疾患の中でも死亡率の高い疾患であり、著明なやせによる全身衰弱に加え、低血糖、電解質異常、感染症、腎不全、不整脈、心不全などの合併症で救急搬送や入院となることがあります。
救命のための栄養療法・体重増加、合併症の治療が必要ですが、皆さんの回答は急性期の治療において気を付けるべきポイントをしっかり示してくださっていました。
まず「問2.初期対応で優先的に行いたいこと,また入院加療において気を付けたいことはありますか?」について、特に回答の多かった項目とその人数を表に示します。
表1.「初期対応で優先的に行いたいこと、入院加療において気を付けたいこと」への回答
| Refeeding syndrome ・ごく少量からの栄養管理 ・栄養は緩徐に増量する |
35人 |
| ウェルニッケ脳症 ・ビタミンB1補充 ・ビタミンB1を補充してから栄養投与を開始 |
23人 |
| 電解質の測定と補正 ・カリウムの補正 ・リンの測定・補充 ・マグネシウムの測定・補充 |
29人 |
他には
・低K、低Pによる不整脈に備えて心電図をモニターする
・痙攣のコントロールが必要であれば抗痙攣薬を使用する
・精神科診察や自殺予防のための介入が必要
という回答も複数いただきました。
「問1.追加で行いたい診察や検査」への回答は、
・表1に挙げた疾患の鑑別
・脳炎・脳症をはじめとした意識障害を呈する疾患の鑑別・除外
・低K血症をはじめとした電解質異常の原因検索
を念頭に置いたものが多かったです。以下に主なものを示します。
●問診
|
食事や栄養について(最多) |
食事はどのくらいの量が摂れていたか |
|
入院前と入院後の食事状況 |
|
|
食事摂取不良の期間 |
|
|
精神科へ入院中の摂取エネルギー |
|
|
中心静脈栄養を行っていたかどうか |
|
|
記憶障害の詳細 |
記銘力低下? |
|
意識変容? |
|
|
作話の有無? |
|
|
薬剤関連 |
利尿剤の乱用 |
|
下剤の乱用 |
|
|
精神科の処方の詳細 |
|
|
サプリメントや漢方の内服がないか |
|
|
overdoseの既往 |
●身体所見
改めて詳細な意識レベルの確認をする、神経所見を取り直すという意見が多く、具体的な項目としては、項部硬直、舌咬傷、腱反射などが挙がりました。
●血液検査
血清P、Mg、ビタミンB1が並んで多く、いずれも25人以上の方が挙げてくださいました。次いで、甲状腺ホルモン、コルチゾール、カルシウム、葉酸、微量元素、血液以外の検査として髄液検査、尿検査が挙がりました。
●画像検査
最も多かったのが頭部MRIでした。不整脈チェックのための12誘導心電図、腫瘍随伴性脳炎を念頭においた腹部CT・MRIという意見も複数見られました。
いずれも重要な所見や鑑別ですが、今回はRefeeding syndromeをポイントに解説したいと思います。
<Refeeding syndromeとは>
Refeeding syndrome(以下,RFS)は、栄養不良状態であった患者に、人工的に栄養(経管栄養でも点滴栄養でも)の投与を開始した結果生じる水分や電解質の移動に伴い、致死的となり得る症候群と定義されています1)。最も問題になる生化学的特徴は低リン(P)血症と考えられていますが、
・水分・Naバランスの異常
・糖代謝の異常
・ビタミン欠乏(ビタミンB1が代表的)
・低K血症
・低Mg血症
などが複雑に関与し、全身性の臓器障害を来す病態です。明確な「診断基準」はありませんが、特に集中治療が必要になるような患者は、低P血症やRFSの高リスクですので、治療の初期から意識しておく必要があります。RFSは栄養開始から72時間以内に生じることが多く、それ以降は大きく可能性が下がる2)とされ、救急外来からの入院でも注意しなくてはなりません。
<RFSのリスク>
英国のNICE guideline3)では、以下を満たす患者はRFSの高リスクとされています。
|
・BMI<16kg/m2 ・3~6か月以内に15%以上の体重減少 ・10日以上の経口摂取不良 ・治療前のK、P、Mg低値、ビタミンB1欠乏 |
また別の報告3)では、次のような項目が高リスクとされており、今回の症例で取り上げた神経性やせ症のほか、ごく一般的な疾患である癌や手術後、また救急外来では稀ならず遭遇するアルコール依存患者やホームレスなども含まれていることが分かります。このような患者さんの初期治療に当たる場合は、RFSを念頭に置いておくことが重要です。
表1.RFSのリスクが高い患者(文献4を参考)
|
神経性やせ症 |
ホームレス |
|
高齢 |
妊娠悪阻 |
|
クワシオルコル、マラスムス |
1~3か月以内に10%の体重減少 |
|
担癌患者 |
理想体重の70%以下 |
|
手術後、消化管異常 |
サルコペニア |
|
アルコール依存 |
NPOが7日以上 |
|
慢性肝障害 |
不適切な栄養が10日以上 |
この症例では、神経性やせ症自体がリスクであることに加え、
入院時の体重:29.8kg、身長:154㎝、BMI:12.6
理想体重は45+0.91×(154-152.4)≒46.5ですので,その70%以下の体重
という点でも高リスクであり、少量のカロリーでもRFSを引き起こす可能性があります。
<RFSの病態>
飢餓・低栄養状態に陥ると肝臓に貯蔵されたグリコーゲンが枯渇するため、グルカゴンが上昇しインスリンが減少します。そして体内のエネルギー源は、糖代謝から脂質分解および蛋白異化亢進の代謝に移行します。飢餓状態が進行すると、体内のATPが枯渇(細胞外のPが減少)しますが、リン酸塩は細胞内から血清に動員され、また尿排泄が低下することから、Pの血清濃度はある程度一定に保たれます。
この状態で栄養が再開されると、糖代謝が急激に亢進します。ATPや2,3-diphosphoglycerate(DPG)を産生するためにPが細胞内へ移動し消費されて低P血症が生じます。さらに亢進していた蛋白異化が同化作用に変わり、インスリン分泌の増加、グルカゴンの減少、蛋白同化、脂質合成が促されると、細胞内でP、K、Mgなどの電解質やビタミン、微量元素の需要が急激に高まり、これらが細胞内へ移動します。結果、低P血症、低K血症、低Mg血症などの電解質異常が生じます。(図1も参照)
図1.飢餓状態とRFSの代謝の流れ(文献5を参考)
|
飢餓・低栄養 ↓ 糖新生、脂質分解、蛋白異化亢進 ↓ 体重減少(しばしば数か月で10%以上) ↓ 脱水、ビタミン・電解質欠乏 ↓ refeeding(再栄養) ↓ 糖が栄養源となる ↓ インスリン分泌増加 ↓ グルコースが細胞内へ取り込まれる 蛋白同化 ↓ P、Mg、Kが細胞内へ取り込まれ、低P、低Mg、低K血症が生じる ↓ ビタミンB1(既に不足病態である)が糖代謝に利用され、欠乏する |
<症状>3)
●低P血症
まず、低P血症による症状をまとめます。PはATP、2,3-DPG、核酸などの合成に関わるため、表2の通り多臓器にわたる症状を引き起こします。
表2.低P血症の症状
|
神経 |
昏睡,痙攣,脳症,麻痺 |
|
心血管 |
不整脈,心不全 |
|
呼吸器 |
呼吸筋減弱,呼吸不全,人工呼吸器離脱困難 |
|
血液 |
溶血,白血球機能障害 |
|
筋骨格 |
脱力,筋痛,横紋筋融解,骨減少,骨軟化 |
今回の症例のように、低栄養状態の患者が入院した場合、点滴や経管での栄養が開始されるでしょうから、RFSの症状としての痙攣や意識障害は積極的に疑う必要があります。
ATPは筋収縮や神経伝達、電解質輸送に大きく関与しています。例えば心筋内でのATP減少は心収縮力低下を起こし、心不全を生じます。低P血症自体が不整脈の原因にもなります。
筋力が低下することにより、人工呼吸器管理をしている患者において横隔膜の収縮が減弱し、呼吸器からの離脱困難となるリスクが高まります。また2,3-DPGは細胞内への酸素運搬機能を担っているため、その低下は末梢組織への酸素供給を減少させます。
赤血球でのATPは細胞膜の変形や維持に関わっているため、低P血症によってATPが減少すると赤血球の溶血が生じます。白血球の走化性や貪食能、血小板凝集能も低下します。
低P血症以外にも、様々な病態が症状を引き起こします。
●水分・Naバランス異常
急速な炭水化物(糖)の投与はインスリンの分泌を亢進させますが,インスリンはNaと水分の腎排泄を抑制します。それにも関わらず、尿量を指標に(正常な尿量を維持しようとして)補液を継続すると、volumeが過剰となりうっ血性心不全や肺水腫を生じる可能性があります1)。
●糖代謝の異常(高血糖/低血糖)
脂質代謝の状況下で再栄養(糖負荷)されることにより一時的に高血糖を生じますが、その後インスリン分泌が増加するため低血糖を来します。本症例では血糖値は正常範囲でしたが、意識障害の鑑別としてまず血糖をチェックすることも忘れてはいけません。
●ビタミン欠乏
摂取不足と代謝亢進によりビタミンB1が欠乏し、Wernicke脳症や乳酸アシドーシスを呈します。
本症例の患者さんは追加で問診をすると、無茶な飲酒も繰り返していたということが分かり、Wernicke脳症やアルコール離脱も否定できないと考えました。ビタミン自体は前医でも投与されていましたが、転院後にビタミンB1大量投与を行いました。幸い痙攣の再発はなかったので、ベンゾジアゼピンは使用しませんでした。
●低K血症、低Mg血症
Mgは細胞内代謝の補酵素として働き、ATP生成の過程や膜電位の形成に関わります。低K血症・低P血症とともに不整脈の原因となります。
<検査>
ここまでに述べたように、RFSは様々な因子が絡み合っていますが、血清P値のフォローは重要です。ただ、体内のPのうち細胞外に存在するのはわずか(0.1%)で、ほとんどは有機リンとして蓄えられていること、血液検査で測定されるのは主に血中の無機リンであり必ずしも体内のP不足が血液検査値に表れない可能性には注意が必要です。
フォローの頻度については重症度や文献によって2時間~12時間ごとと様々ですが4)、Pは他の電解質と比較しても急激に低下することがあり、飢餓状態やRFSのリスクがある患者に栄養を開始する際は、頻回にPの値を測定し、必要に応じた補正が必要ということです。
KやMgもほとんどが細胞内に存在し、血清濃度のみで欠乏を診断することはできませんが、経時的なフォローは不可欠です。
<治療>
NICE guideline3)では、RFSのリスクが高い患者に対して、最大でも10kcal/kg/日の栄養から投与を始め、4~7日かけて必要量までゆっくりとカロリーを増量していくことを推奨しています。特に、BMI<14 kg/m2、15日以上食事をしていなかった等の非常にリスクの高い症例では、5kcal/kg/日から開始し、持続的な心電図のモニタリングも必要としています。徐々にカロリーを増量する方法について、リスク毎に推奨するペースをまとめた文献もありましたので、参考に示します(文献5)。
電解質の1日の必要量は以下の通り3)ですが、血液検査で経時的にモニタリングし補正をする必要があります。
K(2-4mmol/kg/day)
P(0.3-0.6mmol/kg/day)
Mg(経静脈的に0.2mmol/kg/day)
特にPの補正(低P血症の治療)についても様々な記載がありますが、一例を挙げておきます6)。
|
|
重度 |
中等度 |
軽度 |
|
血清P値 |
<0.4mmol/L (=1.24mg/dL) |
0.4-0.6mmol/L (=1.24-1.86mg/dL) |
0.6-0.79mmol/L (=1.86-2.25mg/dL) |
|
治療 |
経静脈的に6時間かけて0.16-0.24mmol/kg |
経静脈的に6時間かけて |
経口で1000mg/日 |
|
6-12時間ごとに血清P値をチェック |
|
||
|
|
|||
また、容易にvolume overとなるため、カロリーだけでなく水分バランスにも注意が必要です。
栄養開始前と最初の10日間は、200~300mg/日のチアミンも投与することが推奨されています。
<今回の症例について>
皆さんから指摘をいただいた「記憶障害」の詳細については、家族は「ぼーっとした感じ」としか表現できなかったのですが、診察上は軽度の見当識障害(日付を答えられたり応えられなかったりする)、短期記憶の障害があったようです。
利尿剤や下剤などの乱用はありませんでしたが、嘔吐をする目的なのか普段は缶ビールやチューハイ5本程、入院前は瓶ビールを飲んでいたという病歴が得られました。RFSにおいてもビタミンB1の補充は重要ですが、さらに飲酒歴も判明したため、ウェルニッケ脳症の可能性を念頭にビタミンB1補充を続けました。アルコール離脱の可能性もあると考えたのですが、幸い痙攣の再発はなく、抗痙攣薬を使うことはありませんでした。
ちなみに、アルコール離脱症候群については過去にEMA教育班で取り上げていますのでぜひご覧ください。
症例提示 https://www.emalliance.org/education/case/syourei89
解説 https://www.emalliance.org/education/case/syourei89kaisetsu
栄養の詳細ですが、入院前の食事量についてはご家族も把握できていませんでした。入院した最初は末梢静脈から240kcal/日ほど、翌日は経管栄養を少量開始し300kcal/日ほどが投与されていました。10kcal/kg/日に見合った量ではありますが、よりリスクの高い例ではRFSを起こす可能性も否定はできません。
追加で提出した検査結果を以下に示します。
■血液所見:
Mg 1.5 mg/dL、P 1.8 mg/dL、TSH 0.53 μU/mL、FT3 2.62 pg/mL、FT4 1.35 ng/dL、NH3 35μg/dL、
ビタミンB1 上限以上(前医で補充済みのため)
■頭部MRI:明らかな異常認めない
低P血症は中等度ではありましたが中心静脈を確保してPとKの補充を行い、またAラインを留置して頻回に電解質のチェックを行ったところ、さらなる低下は認めず、意識レベルも通常程度まで回復したため、精神科の病棟へ移ることができました。
<Take Home Message>
●飢餓・低栄養状態の患者に治療開始するときは、Refeeding syndromeの可能性を忘れないようにしよう
●神経性やせ症、癌、術後、アルコール依存、ホームレスなどは高リスク
●著明な痩せ(BMI<16kg/m2、3~6か月以内に15%以上の体重減少)や、長期間(10日以上)の経口摂取不良も高リスク
●Pに加え、K、Mgも頻回チェック+補正
●ビタミンB1も忘れずに
<参考文献>
1) Hisham M Mehanna, et al. Refeeding syndrome: what it is, and how to prevent and treat it? BMJ 2008; 336: 1495-98.
2) Natalie Friedli, et al. Management and prevention of refeeding syndrome in medical inpatients: An evidence-based and consensus-supported algorithm. Nutrition. 2018; 47:13-20.
3) National Institute for Health and Clinical Excellence (NICE): Nutrition support in adults. Oral nutrition support, cebtral tube feeding and parenteral nutrition. NICE clinical guideline 32, 2006.
4) Byrnes MC, et al. Refeeding in the ICU: an adult and pediatric problem. Curr Opin Clin Nutr Metab Care. 2011; 14: 186-92.
5) M.A Crook, et al. The importance of the refeeding syndrome. Nutrition. 2001; 17: 632-7.
6) Boland K, et al. IrSPEN Guideline document No.1: Prevention and Treatment of Refeeding Syndrome in the Acute Care Setting. November 2013. <http://www.irspen.ie/wp-content/uploads/2014/10/IrSPEN_Guideline_Document_No1.pdf>