EMA症例133:5月症例 解説
2022年5月症例にご参加いただきました皆様、誠にありがとうございます。5月26日時点で質問に回答をいただいた方は278名いらっしゃいました。今回のテーマは「難治性アナフィラキシー(refractory anaphylaxis)」でした。致死的なアナフィラキシーでは、低血圧、神経学的障害、心停止が急速に起こる結果、呼吸停止や心停止までの時間の中央値は反応発現後5~30分という報告もされており[1]、Commonな疾患ながら救急医のみならず、多くの臨床医が冷や汗をかいてきた恐ろしい疾患でもあります。難治性アナフィラキシーは最近「3回以上の適切な量のアドレナリン投与(または持続点滴)を必要とするもの」と定義されました[2]。今回、アドレナリン筋注では太刀打ちできないアナフィラキシーショックにどういった選択肢があるのか、病態生理にも触れながら解説をしてまいります。さて、本症例のキーポイントを最初にお示しいたします。
1. 血液分布異常性だけじゃない、アナフィラキシーの病態生理を知ろう。
・血管外漏出による循環血液量減少性ショック。
・血管拡張による血液分布異常性ショック。
・心収縮力の低下+(おそらく)不相応な徐脈による心原性ショック。
2. 持続アドレナリンの使い方を知ろう。
・筋注2回でも太刀打ちできない重症アナフィラキシーショックに考慮。
・有害事象を避けるため、希釈した薬液で慎重に投与。
・中等症なら0.08γ、重症なら0.16γで開始。
3. グルカゴン、メチレンブルーの使い方を知ろう。
・グルカゴン:アドレナリンシグナルとは無関係に、陽性変力作用を発揮。
・グルカゴン:1-5mg(小児は20-30μg/kg)5分かけて静注、5-15μg/minで持続投与。(注
・メチレンブルー:可溶性guanylate cyclaseとNO合成酵素阻害による血管抵抗増加作用。
・メチレンブルー:1-2mg/kg静注、0.25-2mg/kg/hrで持続投与。
(注:グルカゴン1mgは1国際単位に相当する)
次に皆様の回答の集計結果を紹介します。
質問1:この患者で予想される病態を選んでください。(複数選択可)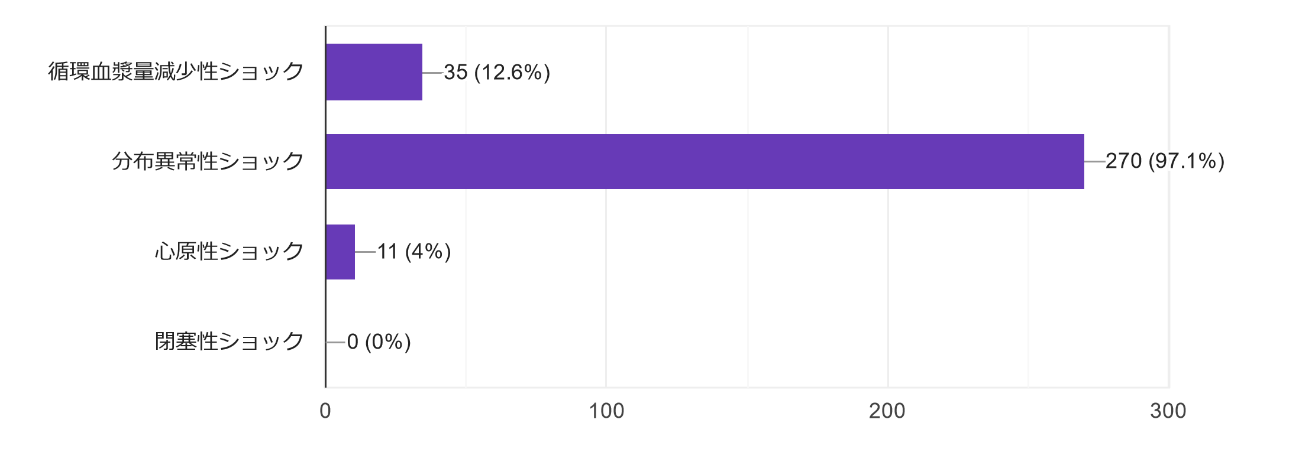
質問2:現時点(来院時)で行う治療を選んでください。(複数選択可)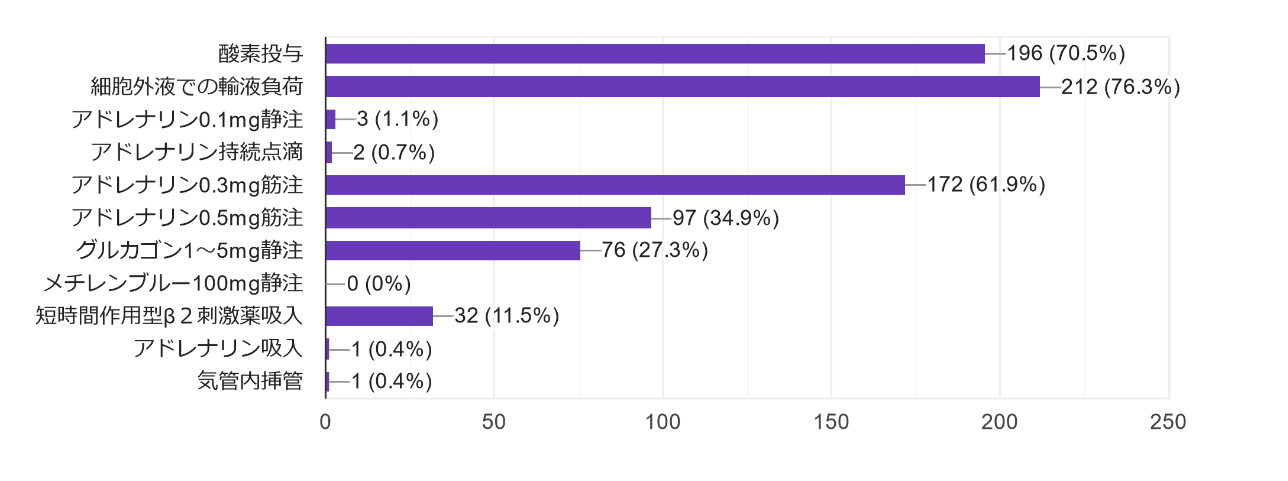
質問3:現時点(外液負荷、2回目のアドレナリン筋注後も血圧60/30mmHg)で行う治療を選んでください。(複数選択可)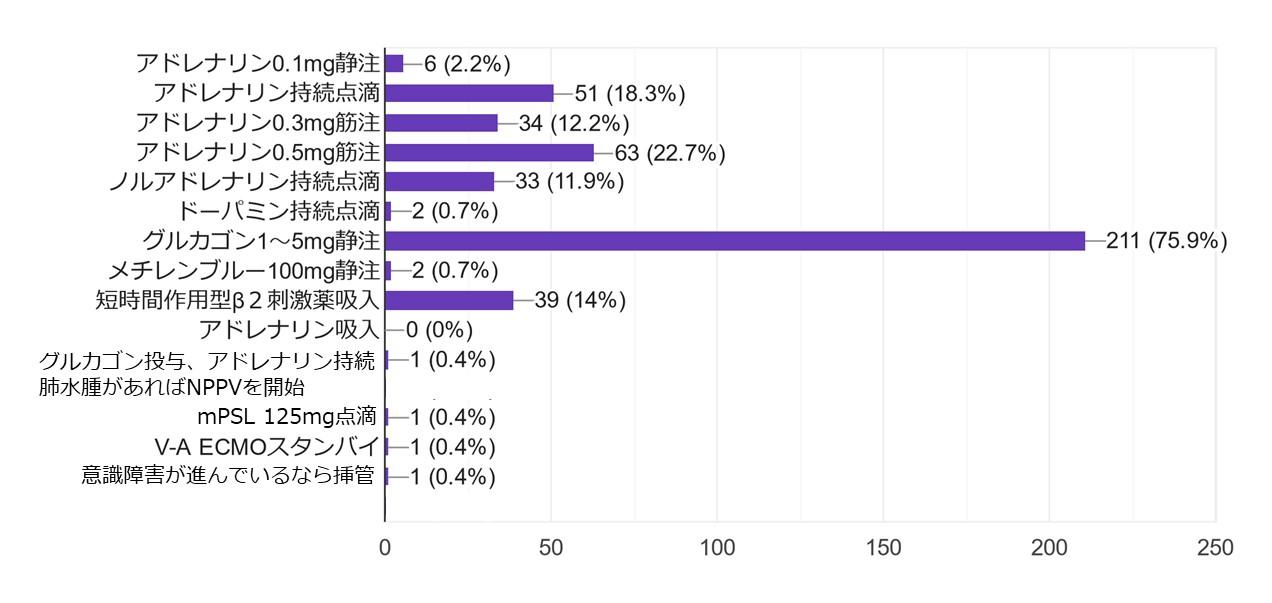
質問4:あなたの属性を教えてください。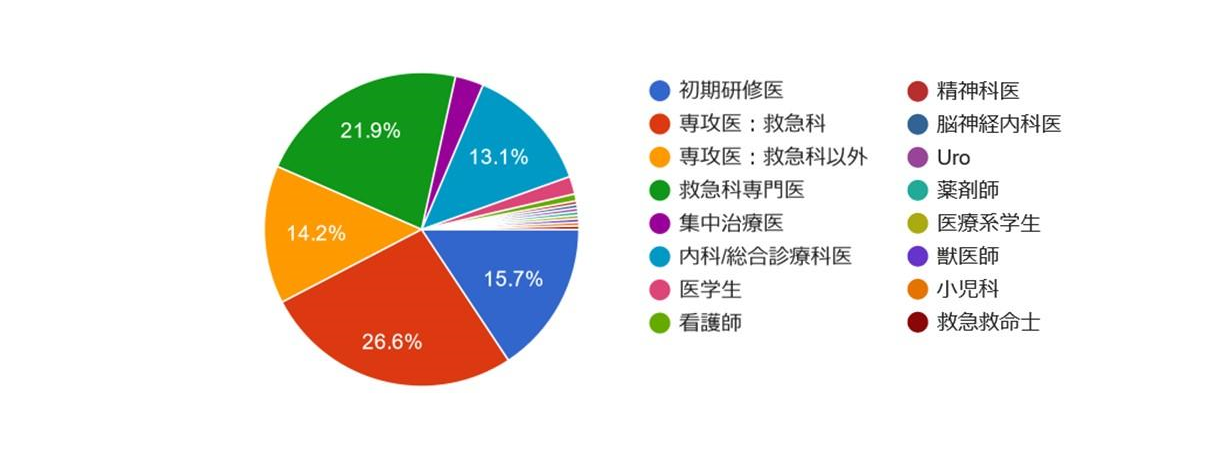
その後の症例の経過:
3回目のアドレナリン0.5mg筋注、グルカゴン3mg単回静注、アドレナリン持続投与を開始しました。アドレナリン0.05γほどの投与で平均動脈圧65mmHgを維持できるようになり、その後2時間かけて徐々に漸減、終了となっています。一般病床へ転棟後、アレルギー科に紹介しアドレナリン自己注射製剤処方の上、退院後に外来フォローとなりました。
解説:
1 血液分布異常性だけじゃない、アナフィラキシーの病態生理を知ろう
アナフィラキシーショックと言えば、血液分布異常性ショックの代表的な存在ではないでしょうか。しかし、実はアナフィラキシーで生じるのはそれだけではありません。様々なメディエーターが関与することを反映して毛細管液漏出による循環血液量減少性ショック[3-5]、血管拡張による血液分布異常性ショック[3,6-8]、および心収縮力の低下[9]とおそらく不相応な徐脈[10]による心原性ショックのさまざまな要素からなることが示唆されています。
現在までに報告されたヒトでの研究で最も重要なものとして、麻酔下で発生した205件のアナフィラキシーショックを記録した研究があります[4-5]。この研究では、発症から10分以内に循環血液量の最大35%が血管外に漏出することがヘマトクリットの増加によって示されています[5]。また別のアナフィラキシー患者の報告では、アナフィラキシー発症3時間後の測定で、肺血管抵抗の増加、肺動脈楔入圧の減少、心拍出量の減少、および全身血管抵抗の上昇が認められています[11]。アトロピン静注で治療された2名の重度徐脈を伴ったアナフィラキシーの報告もあり、この記録では血圧の低下とともに心拍数が低下したとなっています[12]。これは、心臓の過収縮に反応した機械受容体によって生じた反射が、セロトニン、カテコールアミン、プロスタグランジン、一酸化窒素によって増強されて生じたのではないかと推測されています[10]。
これらの報告だけでも、アナフィラキシーによって多種多様な変化が身体に生じていることが想像できますね。では次に、その変化を引き起こしたであろう各種メディエーターについて調べてみましょう。
アレルギーといえばヒスタミンのイメージがあるとおり、もともとはヒスタミンがアナフィラキシーの主要なメディエーターであると考えられていました。しかし、研究が進むにつれて膨大な種類の炎症性メディエーターがアナフィラキシーに関与していることが明らかになってきました(表1)[13]。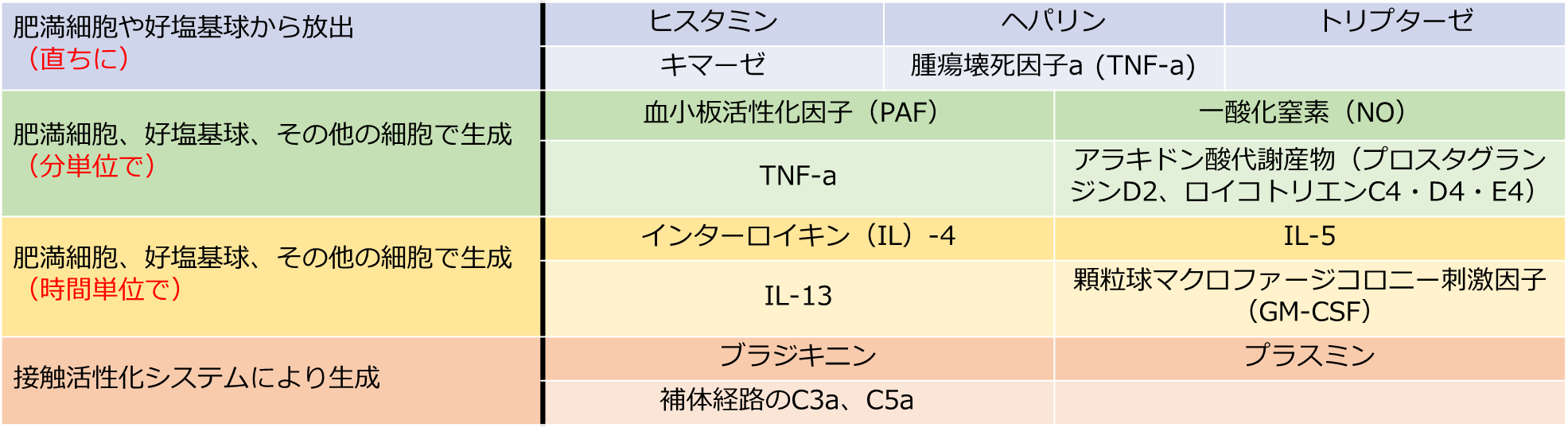 表1. アナフィラキシーに関連する炎症性メディエーター
表1. アナフィラキシーに関連する炎症性メディエーター
これを見ているだけで頭がクラクラしてきますが、気持ちを強く持って、ひとまず代表的なものがどういう作用を持つかについてもう少し取りあげましょう。
<ヒスタミン>
ヒスタミンを冠動脈注射すると、平均大動脈圧の急速な低下と冠動脈血流増加を引き起こした報告があり、主に血管平滑筋に発現するH1受容体の活性化によるものとされます[14]。さらに、不整脈と房室伝導ブロックを誘発する可能性も示唆されました[15]。一方でヒスタミン静注により冠動脈の血流低下や激しい攣縮も報告されています[16]。したがって、ヒスタミンはアナフィラキシーの死因となりうる不整脈や虚血性変化に関与している可能性があるとされます。
<アラキドン酸代謝産物>
ロイコトリエンD4の静脈内または冠動脈内注入は、小さな冠動脈の著しい収縮を生じ、冠動脈血管抵抗の急速かつ持続的な増加を引き起こします[17,18]。心筋灌流を低下させることによって、心臓の収縮機能に大きな影響を与える可能性があるとされます。
<血小板活性化因子(PAF)>
PAFは冠動脈血流を著しく減少させ、肺血管抵抗上昇、心拍出量低下を引き起こすとされます。また、心筋細胞のKイオンチャンネルと相互作用する能力があるため、直接的に不整脈を引き起こす作用もあると推測され[19]、NOを誘導することから末梢血管拡張も励起します[13]。これらの結果から、PAFは種々の重症アナフィラキシーの血行動態異常に関わるとされています。
いかがでしょうか。「アナフィラキシー=分布異常性ショック」というイメージが少し変わったのではないでしょうか。ありふれた疾患にも奥深い病態生理があり、一筋縄ではいかない時には、その理解がきっと助けになるはずです。
2 持続アドレナリンの使い方を知ろう
アナフィラキシーの治療と言えば ですね。アドレナリンは肥満細胞からの脱顆粒やメディエーター産生抑制につながるため、第一選択となっているのは過去のEMA解説(https://www.emalliance.org/education/case/kaisetsu120)でも取り上げたとおりです。アドレナリン以外の昇圧薬(ノルアドレナリン、ドーパミン、バソプレシンなど)も使用することはありますが、アドレナリン持続点滴が奏功しなかった場合に考慮するという位置づけになっています[20]。
アドレナリン筋注の投与量については12歳以上では0.5mg、体格の小さな小児では臨床効果に応じて漸増し0.01mg/kg(最大500μg)が推奨されています。ただし、高用量の方がより高い血中濃度を示した研究はあるものの、アナフィラキシー患者の臨床経過に対して用量が具体的にどのような影響を及ぼすかはわかっていません[21-23]。一方で、アドレナリンに対する反応不良はアドレナリンの用量不足と、薬剤が十分に循環できない循環動態の両者が原因と考えられています[10,24-25]。病態生理で記載したとおり、アナフィラキシーショックでは急速な循環血漿量減少が生じるため、1回心拍出量の回復に関しては、アドレナリン筋注単独よりも500-1000mlの細胞外液輸液を併用した方が効果的であったとされています [26]。そのため、循環動態の不安定性を伴う場合、各種ガイドラインにおいても十分量の輸液を行うよう勧告がされています[27-29]。
アドレナリン筋注の間隔は5-15分と各種ガイドラインでは記載されていますが、5分以上待つ根拠は不明です[21]。重症者においては5分間隔で投与しているのが実際でしょう。
アドレナリン持続点滴については、ガイドラインでも重症者における選択肢とされています[27-29]。根拠として、筋注や静注(ボーラス)より持続点滴の方が循環動態の結果が優れていたという動物実験や [25]、持続点滴が安全かつ有効であったというケースシリーズ[10,30]があります。しかし、持続点滴を使い慣れている人はそう多くありません。アドレナリンによる合併症自体は投与経路にかかわらず報告されていますが、「過度に急速な静脈内注入、ボーラス投与、原液使用などによる用量間違い」があるとより起こりやすいとされます[21]。やはり、希釈した薬液で慎重に行われるべきであり、目の前の難治性アナフィラキシーによる死亡リスクと治療による合併症リスクの間でバランスをとらないといけません。
難治性アナフィラキシーにおけるアドレナリン持続投与の方法に明確な決まりはありませんが、過去の報告で用いられた方法を参考までに提示します[10]。それぞれの施設で規定の組成があればそちらを用いても問題ありません。
第二選択昇圧薬に関しては、「ドーパミン、ドブタミン、ノルエピネフリン、フェニレフリン、バソプレシン(アドレナリン単独に追加、または互いに比較)の明確な優位性は、臨床試験で実証されていない」のが実際です。オーストリアのガイドライン(2020年)では、アドレナリンの持続点滴が無効な場合にのみ他の昇圧薬の検討を推奨しています[21,29]。
アドレナリン筋注2回実施しても反応が不十分な場合、早期に専門家への相談が推奨されていますので [21]、急性期のバイタル管理の専門家である救急医はいざという時にスムーズに対応できるようにしておきたいですね。でもご安心ください。2回のアドレナリン筋注に反応しないのは0.37-3.4%と決して多くありません[31,32]。
3 グルカゴン、メチレンブルーの使い方を知ろう
さて、通常診療ではなかなか昇圧の選択肢として挙がることのない薬剤ですが、通常の昇圧薬とは薬理作用が異なるため、備えとして確認しておきましょう。
<グルカゴン>
1960年にFarahとTuttleはグルカゴンが心臓に作用し、心拍出量を増加させることを示しました[33]。グルカゴンの循環器系への作用は、投与後1〜3分程度で現れ、5分後にピークを迎え、最大20分まで持続します。陽性変時作用および陽性変力作用は、カテコラミンほど顕著ではない一方、持続時間が長く、また、不整脈のリスクの増加を伴わないとされます[34]。グルカゴンの陽性変時作用はプロプラノロールで阻害されますが変力作用は影響をうけません。つまり、心筋収縮力に対するグルカゴンの作用は、アドレナリンシグナルとは無関係であるとされます[35]。
グルカゴンの循環器系への作用は、adenylate cyclase の活性化およびそれに続く心筋でのcAMPの産生の増強によって達成されるため、アドレナリン受容体の活性化を必要としません。したがってβブロッカー使用中でも心機能の改善を可能にするというのが大きな利点とされます[33]。投与方法は1-5mg(小児では20-30μg/kg)5分かけて静注し、5-15μg/minで持続静注を開始、症状に合わせて増減となります[20]。
<メチレンブルー>
医学の世界で初めて使用された完全な合成医薬品です。繊維工業用のアニリン染料として開発され、Robert Kochが結核菌の顕微鏡観察用染色液として使用したのが最初とされます。EhrlichとGuttmanはマラリアの治療に応用し、第二次世界大戦末期まで実際に抗マラリア剤として米軍兵士に使用されましたが、尿が青緑色に、眼の強膜が青色に変色することから評判は悪かったようです。また、精神科領域において服薬状況を示す染料として使用されたこともあります。最近では、毒素によるメトヘモグロビン血症や遺伝性のメトヘモグロビン血症の治療に有効であることが認識されるようになりました。あまり馴染みがないですが、歴史的には様々な役割を果たしていたのが興味深いですね。
分子式(C16H18ClN3S・3H2O)、化学名3、7-bis (dimethylamino)-phenazathionium chloride tetramethylthionine chloride(17、18)の複素環式芳香族化合物で、水に溶け、酸化されると濃い青色を呈し、還元状態では無色の物質です(ロイコメチレンブルー)。pHを3-4.5に調整するために少量の水酸化ナトリウムまたは塩化水素が添加されています[36]。
メチレンブルーは、半減期は5.25-6.6時間となっています[37]。経口投与での吸収は53-97%、分布容積は0.02-21L/kgと幅が大きく、さらに臓器によって分布が異なると報告されています[36,38,39]。摂取後の経口濃度のピークは1-2時間後ですが、同用量の静脈内投与後の濃度に比べて100分の1以下(80-90 nmols/L vs 8000-9000nmol/L)となっており、この差は、経口投与後の腸壁および肝臓への選択的な分布に起因するとされます[36]。代謝は、末梢組織でのロイコメチレンブルーへの還元が主体(85%)で、尿中への排泄率は、静脈内投与で28.6%、経口投与で18.5%、投与後最大5日間尿中に存在することがあります。メトヘモグロビン血症に対する投与は、通常1-2mg/kgの1%溶液を静脈内投与し、初回投与で効果が不十分な場合に再投与可能です[36]。
メチレンブルーの全身血管抵抗増加作用は、可溶性guanylate cyclase(GC)および一酸化窒素合成酵素(NOS)活性の阻害によるものとされています[40]。NOSは神経性(nNOS)、内皮性(eNOS)、誘導性一酸化窒素合成酵素(iNOS)があり、一酸化窒素を合成します[41]。一酸化窒素は可溶性GCを活性化し、環状グアノシン一リン酸(cGMP)が産生されます。次いで、cGMPの細胞内濃度の上昇が、心筋や血管平滑筋の弛緩と[42]、血管透過性亢進を引き起こすのです[43]。アナフィラキシーで分泌されるヒスタミン、血小板活性化因子(PAF)、ロイコトリエン、腫瘍壊死因子(TNF)などの他の肥満細胞メディエーターはGタンパク質、ホスホリパーゼCを経由してeNOSを活性化し血管拡張とアナフィラキシーショックに寄与していると考えられています。[36]
従って、これらの経路を阻害すれば、血管平滑筋の弛緩、心筋の弛緩、血管透過性の上昇を防げる可能性がありますが、残念ながら、アナフィラキシーにおける有用性は数例の報告に限られています。すべての症例で他の昇圧剤の同時投与があり、メチレンブルーの直接的効果か相乗効果なのかは判断ができません [36]。投与量は100mg静注後、50μg/kg/minを推奨する文献もありますが[44]、決まったものは存在しておらず、敗血症で用いられた1-2mg/kg静注、0.25-2mg/kg/hrの投与が参考にされている様子です[36]。
【メチレンブルーの副作用】
溶血性貧血、嘔気嘔吐、腹痛、胸痛、発熱、低血圧、に加え4-15mg/kgの用量ではメトヘモグロビン血症を引き起こす可能性があります。また全身の血管収縮を生じるため肺血管抵抗の上昇や腸管血流の低下リスクがあるとされます[36]。
高用量(5-7mg/kg)では、心電図異常(T波逆転、R波の減弱)、息切れ、胸部不快感、吐き気、下痢、発汗、腹部不快感などが報告されています。4mg/kgを超える用量では、可逆的な皮膚、便および尿の変色が生じます[36]。
いかがだったでしょうか。難治性アナフィラキシーが珍しいのは間違いありません。一生出会うことなく終わる方がほとんどでしょう。しかし一方で、誰かが出会う疾患であるのも間違いないのです。救急医療は救急医のみが提供するものでもありません。今回の解説が皆様のお役に立てれば幸いです。
<Take Home Message>
1. 血液分布異常性だけじゃない、アナフィラキシーの病態生理を知ろう。
・血管外漏出による循環血液量減少性ショック。
・血管拡張による血液分布異常性ショック。
・心収縮力の低下+(おそらく)不相応な徐脈による心原性ショック。
2. 持続アドレナリンの使い方を知ろう。
・筋注2回でも太刀打ちできない重症アナフィラキシーショックに考慮。
・有害事象を避けるため、希釈した薬液で慎重に投与。
・中等症なら0.08γ、重症なら0.16γで開始。
3. グルカゴン、メチレンブルーの使い方を知ろう。
・グルカゴン:アドレナリンシグナルとは無関係に、陽性変力作用を発揮。
・グルカゴン:1-5mg(小児は20-30μg/kg)5分かけて静注、5-15μg/minで持続投与。(注
・メチレンブルー:可溶性guanylate cyclaseとNO合成酵素阻害による血管抵抗増加作用。
・メチレンブルー:1-2mg/kg静注、0.25-2mg/kg/hrで持続投与。
(注:グルカゴン1mgは1国際単位に相当する)
引用文献:
1. Pumphrey RS. Lessons for management of anaphylaxis from a study of fatal reactions. Clin Exp Allergy. 2000;30(8):1144-1150.
2. Dribin TE, Sampson HA, Camargo CA Jr, et al. Persistent, refractory, and biphasic anaphylaxis: a multidisciplinary Delphi study. J Allergy Clin Immunol. 2020;146(5):1089-1096. .
3. Beaupre PN, Roizen MF, Cahalan MK, Alpert RA, Cass. Hemodynamic and two-dimensional transesophageal echocardiographic analysis of an anaphylactic reaction in a human. Anesthesiology. 1984;60(5):482-484.
4. Fisher M. Blood volume replacement in acute anaphylactic cardiovascular collapse related to anaesthesia. Br J Anaesth. 1977;49(10):1023-1026.
5. Fisher M. Clinical observations on the pathophysiology and treatment of anaphylactic cardiovascular collapse. Anaesth Intensive Care. 1986;14(1):17-21.
6. Heytman M, Rainbird A. Use of alpha-agonists for management of anaphylaxis occurring under anaesthesia: case studies and review. Anaesthesia. 2004;59(12):1210-1215.
7. Schummer W, Schummer C, Wippermann J, Fuchs J. Anaphylactic shock: is vasopressin the drug of choice?. Anesthesiology.
8. Kill C, Wranze E, Wulf H. Successful treatment of severe anaphylactic shock with vasopressin. Two case reports. Int Arch Allergy Immunol.
9. Raper RF, Fisher MM. Profound reversible myocardial depression after anaphylaxis. Lancet. 1988;1(8582):386-388.
10. Brown SG, Blackman KE, Stenlake V, Heddle RJ. Insect sting anaphylaxis; prospective evaluation of treatment with intravenous adrenaline and volume resuscitation. Emerg Med J. 2004;21(2):149-154.
11. Silverman HJ, Van Hook C, Haponik EF. . Hemodynamic changes in human anaphylaxis. Am J Med. 1984;77(2):341-344. .
12. Brown SG, Wiese MD, Blackman KE, Heddle RJ. . Ant venom immunotherapy: a double-blind, placebo-controlled, crossover trial. Lancet. 2003;361(9362):1001-1006. .
13. Brown SG. The pathophysiology of shock in anaphylaxis. Immunol Allergy Clin North Am. 2007 May;27(2):165-75, v.
14. Vigorito C, Giordano A, De Caprio L, et al. . Effects of histamine on coronary hemodynamics in humans: role of H1 and H2 receptors. J Am Coll Cardiol. 1987;10(6):1207-1213.
15. Triggiani M, Patella V, Staiano RI, Granata F, Mar. Allergy and the cardiovascular system. Clin Exp Immunol. 2008;153 Suppl 1(Suppl 1):7-11. .
16. Vigorito C, Poto S, Picotti GB, Triggiani M, Maron. Effect of activation of the H1 receptor on coronary hemodynamics in man. Circulation. 1986;73(6):1175-1182. .
17. Marone G, Giordano A, Cirillo R, Triggiani M, Vigo. Cardiovascular and metabolic effects of peptide leukotrienes in man. Ann N Y Acad Sci. 1988;524:321-333.
18. Vigorito C, Giordano A, Cirillo R, Genovese A, Ren. Metabolic and hemodynamic effects of peptide leukotriene C4 and D4 in man. Int J Clin Lab Res. .
19. Montrucchio G, Alloatti G, Camussi G. Role of platelet-activating factor in cardiovascular pathophysiology. Physiol Rev. 2000;80(4):1669-1699. .
20. Lieberman P, Nicklas RA, Randolph C,et al. Anaphylaxis--a practice parameter update 2015. Ann Allergy Asthma Immunol. 2015;115(5):341-384.
21. Dodd A, Hughes A, Sargant N, Whyte AF, Soar J, Tur. Evidence update for the treatment of anaphylaxis [published online ahead of print, 2021 Apr 23]. Resuscitation. 2021;163:86-96.
22. Simons FE, Gu X, Silver NA, Simons KJ. EpiPen Jr versus EpiPen in young children weighing 15 to 30 kg at risk for anaphylaxis. J Allergy Clin Immunol. 2002;109(1):171-175.
23. Duvauchelle T, Robert P, Donazzolo Y, et al. Bioavailability and Cardiovascular Effects of Adrenaline Administered by Anapen Autoinjector in Healthy Volunteers. J Allergy Clin Immunol Pract. 2018;6(4):1257-1263.
24. Smith PL, Kagey-Sobotka A, Bleecker ER, et al. Physiologic manifestations of human anaphylaxis. J Clin Invest. 1980;66(5):1072-1080.
25. Mink SN, Simons FE, Simons KJ, Becker AB, Duke K. Constant infusion of epinephrine, but not bolus treatment, improves haemodynamic recovery in anaphylactic shock in dogs. Clin Exp Allergy. 2004;34(11):1776-1783.
26. Ruiz-Garcia M, Bartra J, Alvarez O, et al. Cardiovascular changes during peanut-induced allergic reactions in human subjects. J Allergy Clin Immunol. 2021;147(2):633-642.
27. Cardona V, Ansotegui IJ, Ebisawa M, et al. World allergy organization anaphylaxis guidance 2020. World Allergy Organ J. 2020;13(10):100472.
28. Muraro A, Roberts G, Worm M, et al. Anaphylaxis: guidelines from the European Academy of Allergy and Clinical Immunology. Allergy. 2014;69(8):1026-1045.
29. Australasian Society of Clinical Immunology and Allergy (ASCIA). Guideline for the acute management of anaphylaxis; 2020.
30. Alviani C, Burrell S, Macleod A, et al. Anaphylaxis Refractory to intramuscular adrenaline during in-hospital food challenges: A case series and proposed management. Clin Exp Allergy. 2020;50(12):1400-1405.
31. Francuzik W, Dölle-Bierke S, Knop M, et al. Refractory anaphylaxis: data from the European Anaphylaxis Registry. Front Immunol. 2019;10:2482. .
32. Patel NKW, Yip AYG, Ierodiakonou D, et al.Chong. Use of multiple epinephrine doses in anaphylaxis: A systematic review and meta-analysis. J Allergy Clin Immunol. 2021 Nov;148(5):1307-1315.
33. Müller TDB, Clemmensen C, et al.Finan. The New Biology and Pharmacology of Glucagon. Physiol Rev. 2017 Apr;97(2):721-766.
34. Glucagon and the heart. Br Med J. 1969;4(5684):635.
35. Glick G, Parmley WW, Wechsler AS, Sonnenblick EH. . Glucagon. Its enhancement of cardiac performance in the cat and dog and persistence of its inotropic action despite beta-receptor blockade with propranolol. Circ Res. 1968;22(6):789-799. .
36. Lo JC, Darracq MA, Clark RF. A review of methylene blue treatment for cardiovascular collapse. J Emerg Med. 2014 May;46(5):670-9.
37. Peter C, Hongwan D, Küpfer A, Lauterburg BH. Pharmacokinetics and organ distribution of intravenous and oral methylene blue. Eur J Clin Pharmacol. 2000;56(3):247-250. .
38. Clifton J 2nd, Leikin JB. Methylene blue. Am J Ther. 2003;10(4):289-291. .
39. Kozaki A, Watanabe J. Dose dependency of apparent volumes of distribution for methylene blue in rabbits. J Pharmacobiodyn. 1981;4(1):49-57.
40. Mayer B, Brunner F, Schmidt K. . Inhibition of nitric oxide synthesis by methylene blue. Biochem Pharmacol. 1993;45(2):367-374. .
41. Kwok ES, Howes D. . Use of methylene blue in sepsis: a systematic review. J Intensive Care Med. 2006;21(6):359-363. .
42. Shanmugam G. Vasoplegic syndrome--the role of methylene blue. Eur J Cardiothorac Surg. 2005;28(5):705-710. .
43. Hölschermann H, Noll T, Hempel A, Piper HM. . Dual role of cGMP in modulation of macromolecule permeability of aortic endothelial cells. Am J Physiol. 1997;272(1 Pt 2):H91-H98. .
44. Francuzik W, Dölle S, Worm M. Risk factors and treatment of refractory anaphylaxis - a review of case reports. Expert Rev Clin Immunol. 2018 Apr;14(4):307-314.
以下のアンケートにもご回答いただけますと幸いです。よろしくお願いいたします。