EMA症例147:9月解説
2023年9 月症例にご参加いただきました皆様、誠にありがとうございます。10月11 日時点で質問に回答をいただいた方は 317名いらっしゃいました。皆様の回答の集計結果を紹介します。
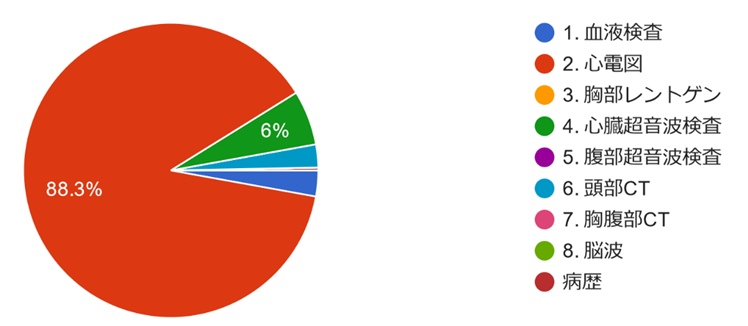
質問1:最も優先する検査を教えてください。
質問2:心電図の解釈を教えてください
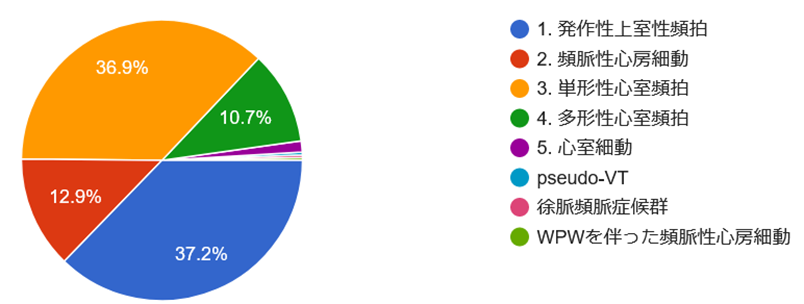
質問3:現時点での頻脈に対する対応を教えてください。

質問4:あなたの属性は?
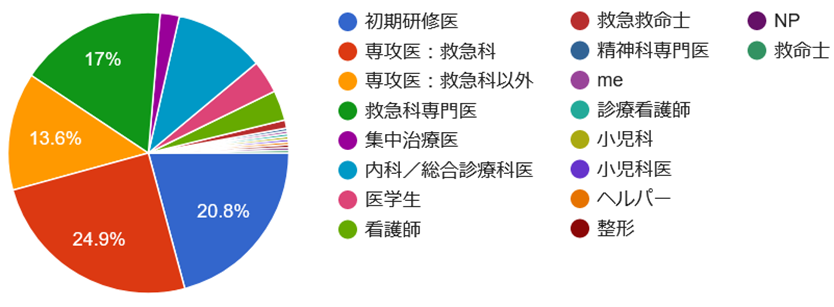
様々な職種の方に回答いただきました。ありがとうございます。失神と言えば心電図が一番気になるという方がやはり多いようです。一方で心電図の解釈については大きく分かれる形となりました。今回の症例の心電図を再掲します。同じ心電図であってもここまで解釈が異なるということ自体を十分に認識して診療にあたる必要があるということではないでしょうか。そして、この解釈の違いがその次の対応の違いに表れているようです。
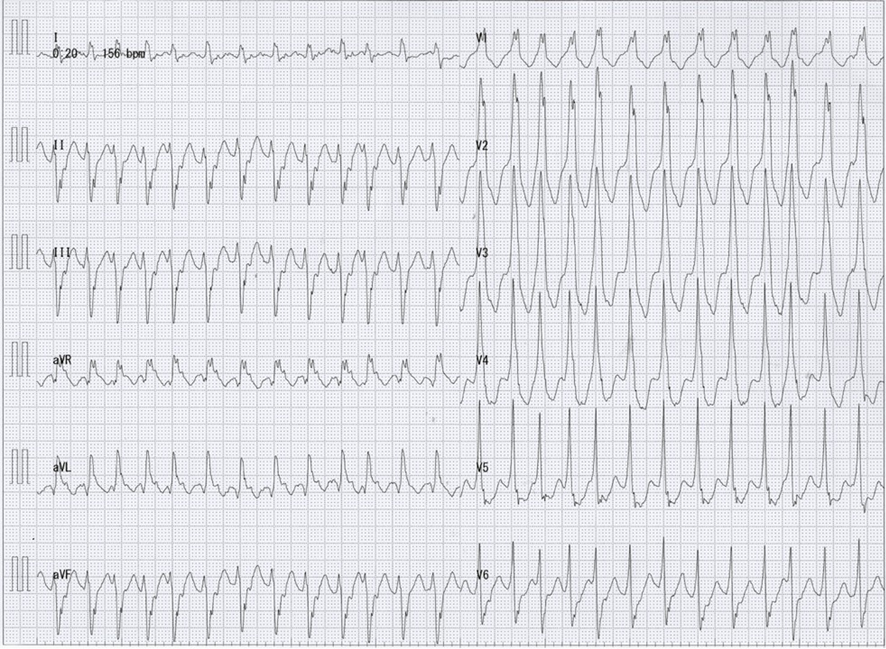
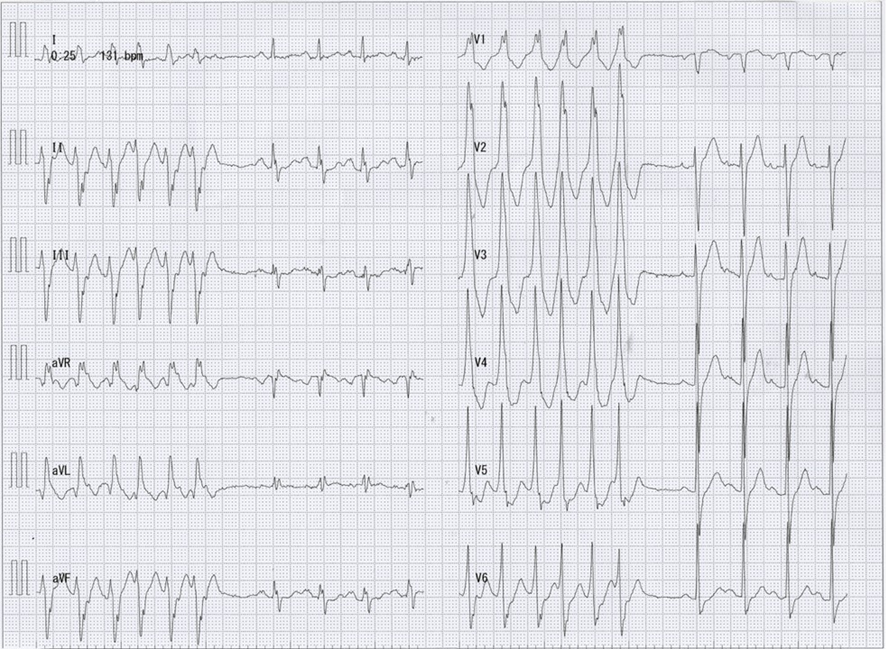
その後の症例の経過:
臥位の状態ではバイタルが保たれているregular wide QRS tachycardiaではありますが、失神で搬送されていることから急変リスクが高いと考えられ、除細動器をそばに置いての対応となりました。変行伝導を伴う上室性頻拍であるか、心室頻拍であるかが協議されましたが、洞調律時のQRS波形とは明確に異なること、完全右脚ブロック波形+左軸偏位であることから、おそらくは左室伝導路を起源とした特発性心室頻拍であろうと判断されました。診断目的のATP投与が行われましたが一切の反応なく、続いて行われたベラパミル5mgの点滴静注によって速やかに洞調律へ復帰し、維持されるようになりました。入院後に心臓電気生理学的検査が行われ、特発性心室頻拍であることの確定診断とともにアブレーションが施行されました。有害事象なく退院し、外来フォローとなっています。
解説:
■不整脈が生じるメカニズム
今回のメインテーマは心室頻拍と変行伝導を伴う上室性頻拍をどう見分けるかですが、その前にそもそも不整脈が生じるメカニズムを確認しなければいけません。
不整脈が生じるメカニズムは大きく①異常自動能、②撃発活動(Triggered activity)、③リエントリーに大別され、本邦の不整脈薬物治療ガイドラインに非常にわかりやすい図が掲載されています [1]。(図1)
図1:正常自動能および不整脈のメカニズム( [1]より引用)
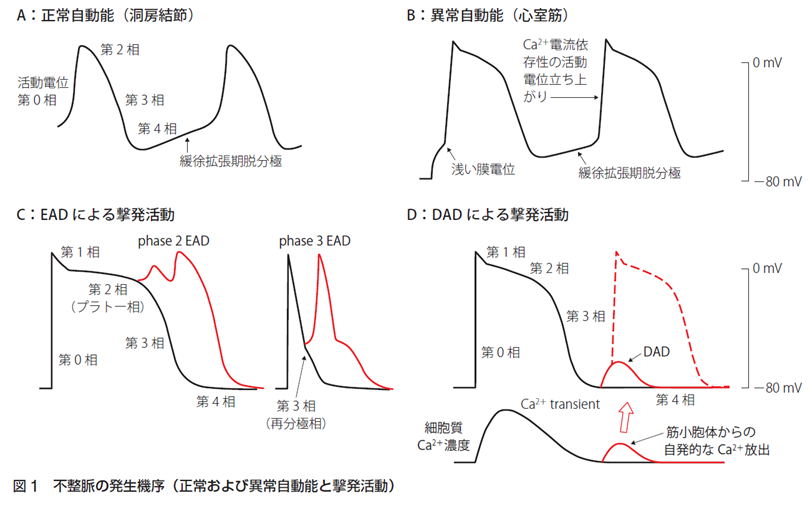
① 異常自動能
もともと洞結節に代表されるペースメーカー組織には「自動能」が存在し、その名の通り自動的に発火し、我々の心臓がリズミカルに収縮することを可能にしています。部位によってこの発火頻度は異なり洞結節で70-80回/分、房室結節で40-60回/分、プルキンエ線維で15-40回/分とされています [2]。Na、K、Ca、Cl、cAMP、cGMP、アセチルコリン、物理刺激など複数の因子が絡み合ってこの自動能を維持しているのですが [3]、最大の特徴はやはり、少し浅い静止膜電位、4相での緩徐な脱分極、0相でのCa流入による活動電位形成でしょう [1] [2]。β受容体刺激ではcAMPを介してCaの細胞内流入が促進されペースメーカー細胞における自動能亢進と、心筋の収縮力上昇を生じます。ムスカリン受容体刺激ではcGMPを介してKチャネルが開口し過分極による発火抑制と、cAMP分解によるβ受容体刺激への拮抗作用が生じます [2] [3]。心房筋や心室筋はこの自動能を通常はもちませんが、さまざまな病態下で静止膜電位が浅くなると自発興奮を生じるようになり、異常自動能を獲得することがあると知られています [1]。このメカニズムによる不整脈には多源性心房頻拍や一部の特発性VTが含まれます [4]。
②撃発活動(Triggered activity)
再分極期に生じる異常な脱分極(後脱分極)によるものとされます。2相~3相で生じる早期後脱分極(EAD)と4相で生じる遅延後脱分極(DAD)に分けられます。
特にプラトー相である2相ではわずかな電流の変化で均衡が崩れ、著明な活動電位時間の延長をきたしEADが発生するとされ、この機序はQT延長症候群におけるtorsade de pointesなど多形性心室頻拍発生トリガーとして重要視されています。したがって低K血症や徐脈、薬剤性などQT延長をきたす疾患ではこちらが懸念されることになります。3相でのEADは心房筋や肺静脈心筋などの活動電位が短い細胞でCa濃度上昇が要因とされます。
DADは細胞内Ca過負荷により筋小胞体からCaが放出され発生するもので、心室性期外収縮から心室頻拍/心室細動の引き金となることが知られています。Ca過負荷をきたす要因としてカテコラミン、ジギタリス、頻脈、低K血症、虚血・再灌流などがあげられます [4] [5]。
③リエントリー
その名の通り、ある心筋の興奮が再び元の部位に戻ってきて同じ心筋を再度興奮させる現象のことを指します。WPW症候群や心筋梗塞瘢痕などを代表とする解剖学的リエントリーと、それ以外の機能的な伝導ブロックによる機能的リエントリーに分かれるとされています [1]。リエントリーが成立しやすくなる条件として代表的なものが3つ指摘されており、1)伝導路が長いこと、2)興奮の伝導速度が遅いこと、3)不応期が短いこと、となっています。
■「心室頻拍」と「変行伝導を伴う上室性頻拍」の鑑別ポイント
心室頻拍とは100回/分以上の頻度で3拍以上持続する心室から発生するリズムという定義が一般的です [6] [7]。ただし125回/分以上かつ16拍以上 [8]、120回/分以上かつ3拍以上 [9]という定義がされていることもあり、国際的な合意にはいたっていないようです [10]。このうち、持続が短いものを非持続性心室頻拍(NSVT)と呼び、持続時間30秒未満とされることが一般的です [11]。
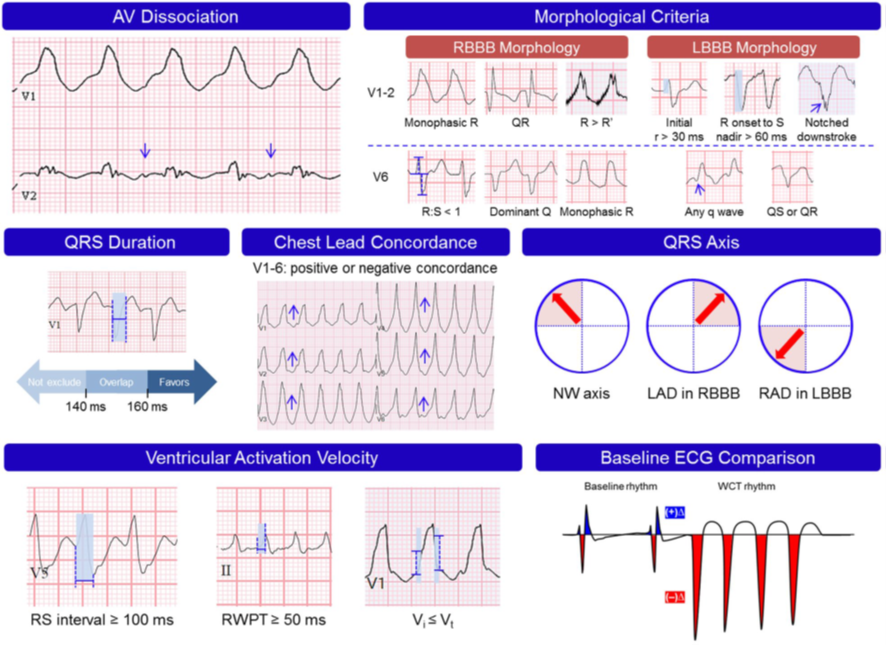
心室頻拍の大半がHis-プルキンエ系以外の心室心筋から発生し、QRS>140msecとされますが [12]、実際にWide QRS tachycardiaの診療で悩ましいのは、目の前の心電図が心室頻拍なのか、変行伝導を伴う上室性頻拍なのかです。代表的な鑑別ポイントは1)房室乖離、2)形態学的基準、3)QRS幅、4)胸部誘導の一致性、5)QRS軸、6)心室発火速度、7)baselineの心電図との違いと言われます [13]。(図2)
図2:Wide QRS tachycardiaの鑑別ポイント( [13]より引用)
1)房室乖離
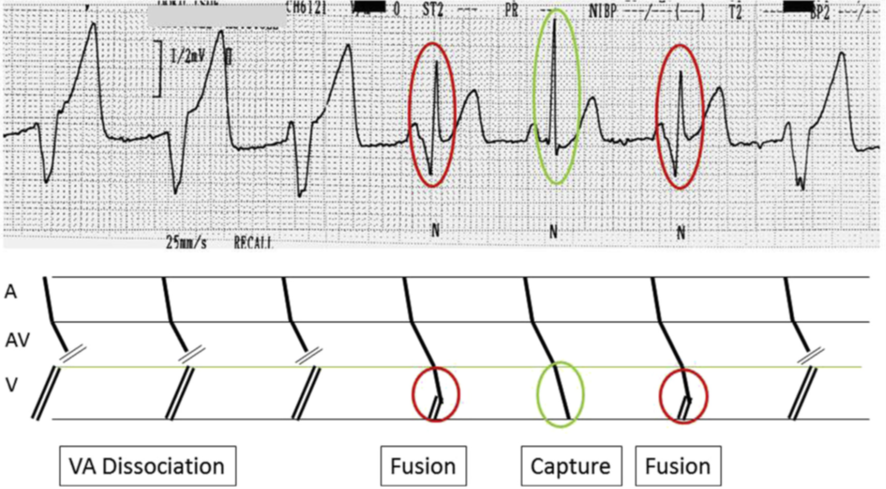
心房活動と心室活動が独立していることを意味し、頻拍が心室起源であることを示します。典型的には図3のように心室活動に対して少ない心房活動となりますが [14]、見ての通り基線の揺れ等で紛れうる繊細な所見であることが弱点となります。心室頻拍での房室乖離では逆行性伝導によって生じた不応期により心房からの伝導がブロックされている状態ですが、タイミングによって心房からの興奮が心室心筋まで伝導することがあります。この現象をCaptureやFusionと呼びます。いずれにしても頻度が高い所見ではなく、房室乖離は感度10.1-50.7%、特異度97.1-100%と報告されています [15] [16]
図3:房室乖離( [14]より引用)
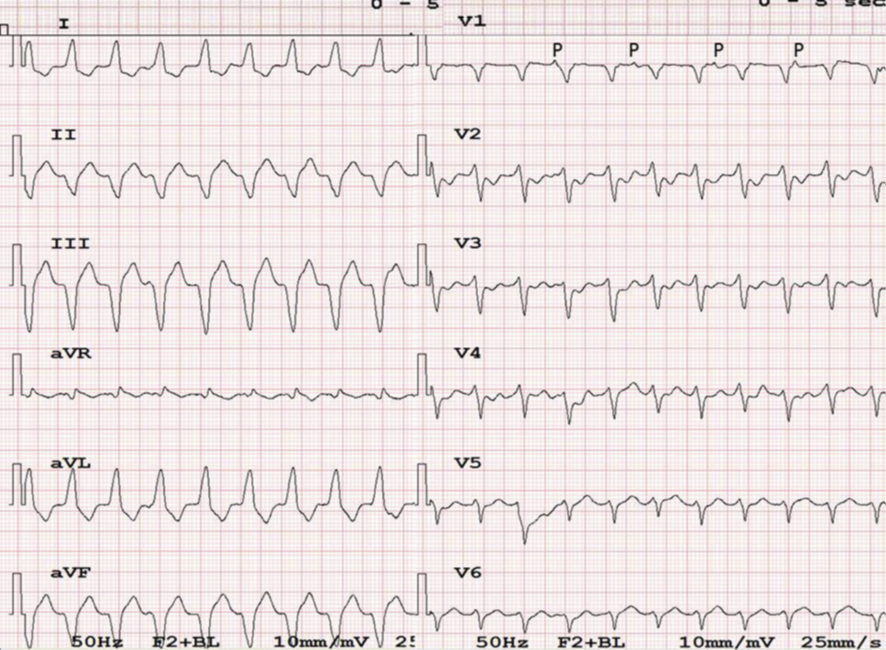
図4:CaptureとFusion( [14]より引用)
2)形態学的基準
古典的な基準として知られるもので1960-80年代に初めて提唱されます。項目が多いように見えるのでうんざりするかもしれませんが、この基準のメッセージは明確で、「右脚ブロックもしくは左脚ブロックと矛盾する波形は心室頻拍の可能性が高い」です。特に左脚ブロック様波形に対する項目は特異度が96-100%と高く、感度は36-63%と今一つながらも知っておいて損はありません [17]。
3)QRS幅
心筋細胞間の伝導は遅いため、心室頻拍は通常長いQRS時間を示すのは周知の事実と思います。そのためQRSが長い方が心室頻拍ではないかと研究が行われ完全右脚ブロック+QRS幅>140msec、完全左脚ブロック+QRS幅>160msecという基準を示したものもあります [18]。しかしこの研究でも心室頻拍の15%が140msec未満であったことや、上室性頻拍の21%で160msec以上であった報告の存在 [19]を考えるとQRS幅で判断するのは困難と心得るべきでしょう。またヒス-プルキンエネットワークより生じる心室頻拍ではQRS幅<120msecの場合もあるとされ、この場合はもはやWide QRSの一般的な定義すら満たさないことになります [13]。
4)胸部誘導の一致性
V1-6全ての胸部誘導でQRS波形が一貫して同じ極性を示す場合を指します。上向きの極性であれば後壁の基部付近、下向きの極性であれば前壁の心尖部付近が起源の不整脈であろうと推測されます。感度11.9-18%と低いながら特異度90-100%と高いため、同じ極性の場合はおおよそ心室頻拍と判断してもよいとされます [13] [16] [19]。ただし、特殊な副伝導路の存在や、フレカイニド中毒などにより上室性頻拍がこのような形態を示したことはあり例外は残されます [20]。
5)QRS軸
上室性頻拍は変行伝導を伴っていようとも、心臓全体としてはある程度伝導の方向に制限が生じます。心室頻拍にはその制限がほとんど存在しないため、QRS軸は有用な情報源となるのです。心電図を方位に見立てた時の北西位と、右脚ブロック+左軸偏位、左脚ブロック+右軸偏位は感度20-23%、特異度96-97%で心室頻拍であるとされます [13] [19]。
6)心室発火速度
QRS幅と似ているようにも見えますが、その一部のセグメントを抜き出して評価することは、より病態生理的に即しているのです。我々のヒス-プルキンエ系は非常に速い伝導を行うため、両脚からプルキンエ線維末端までの所要時間は約0.03秒とされます。プルキンエ線維は心室筋の1/3程度の深さまで存在し、心内膜側から心外膜側までの伝達にはさらに約0.03秒かかるとされます。すなわち、「最初速く後半遅い」ことが上室性頻拍の特徴となります。変行伝導があると修飾はされますが、刺激伝導系を介した部分については同じです。一方で心室頻拍の場合、最初に心筋細胞間の伝導がされ、その伝導の過程でプルキンエ線維に到達するため「最初遅く後半速い」傾向があるとされます [2] [13] [14]。R wave peak time(RWPT)≧50msec(感度65.7-93%、特異度80.2-99%)、QRSの最初(initial)と最後(terminal)の40msecにおける電位を比べたVi≦Vt(感度64.2-82.2%、特異度60-81.9%)は前述の所見と比べると特異度を維持しながらもある程度の感度があり、覚えておきたい項目です [16] [21] [22] [23]。
7)baselineの心電図との違い
もし過去の心電図が利用可能等でbaselineとの比較ができるのであれば活用しない手はありません。40度以上の軸変化がある場合、感度82.6%、特異度63.6%で心室頻拍を同定できるとされます [24]。必ず使えるとは限らないものの、こちらも使用の簡便さでは知っておいて損はしない項目になります。
さて、ここまでは一つ一つの項目での話をしてきました。どれも一長一短で少し物足りないデータだったのではないでしょうか。そこで複数の項目を使用して感度・特異度を改善する試みは様々に行われています。(図5)残念ながら、どれも煩雑さの割に・・・といった結果になっています。そんな中、Point-based Scoring Methodsは項目が多いながらも100%に近い特異度や陽性的中率を示しています。ただし、繰り返しにはなりますが煩雑なため、忙しい救急外来では使用が難しいでしょう [16] [25]。
図5:Wide QRS tachycardiaに対する様々な判別法( [13]より引用)

■特発性心室頻拍
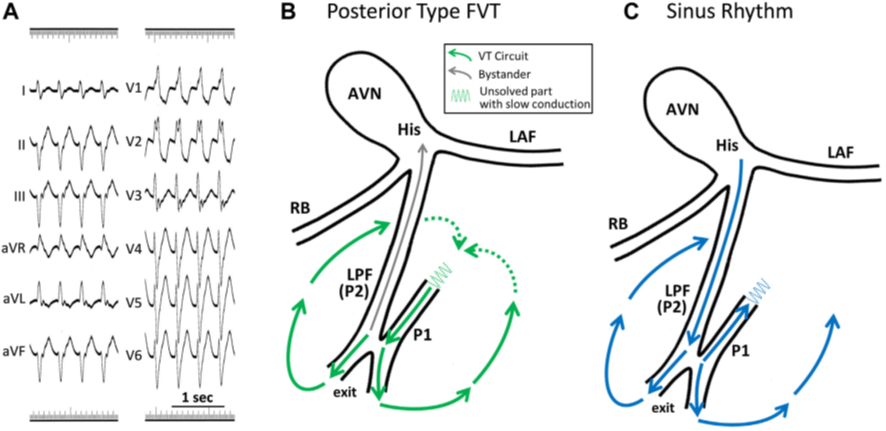
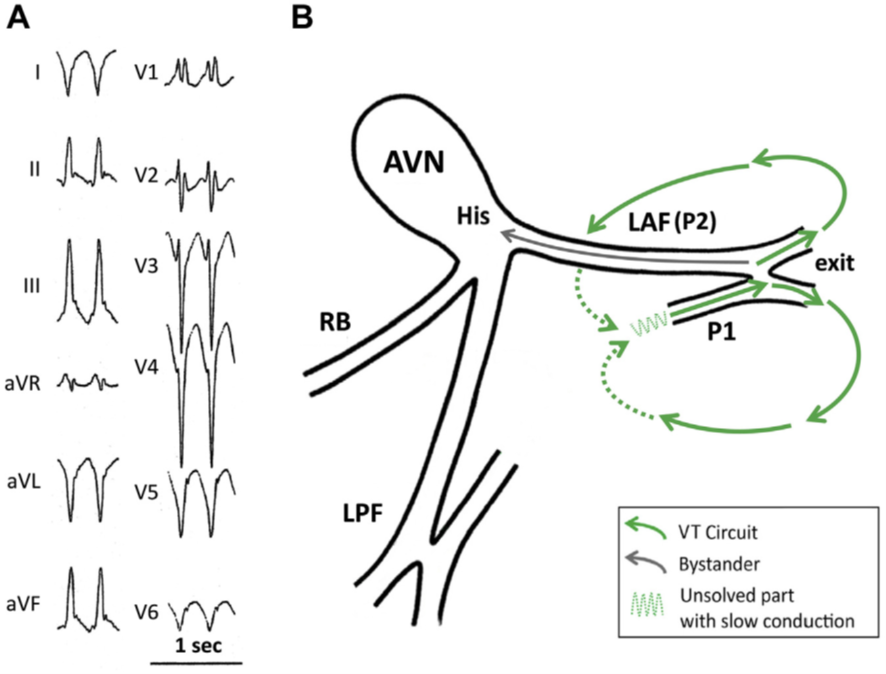
本症例は左脚後枝を起源とする特発性心室頻拍、その中でもFascicular VT(Belhassen VT)と呼ばれるものでした。その名の通り脚などのヒスープルキンエ系を起源とする心室頻拍で、ベラパミルが著効することからベラパミル感受性心室頻拍とも呼ばれます。伝導路から発生するため、心室頻拍としてはQRS幅が比較的短いことも特徴とされます。左脚後枝由来が70-80%、10-15%が左脚前枝であり、この二つの典型心電図をおさえましょう [26]。非常にまれなupper septal typeとreverse typeについては割愛します。後枝由来は右脚ブロック+左脚前枝ブロック波形、前枝由来は右脚ブロック+左脚後枝ブロック波形になります。こうすると、失神の時に見逃してはいけない2束ブロックと同じで、救急医にとっては馴染みがあるはずです。なお、正式には軸偏位の評価が必要ですが、簡便には左脚前枝ブロックはⅡ、Ⅲ、aVFでS波が深く、左脚後枝ブロックはⅠ、aVLでS波が深くなっていることを見るとよいでしょう。
根治的にはアブレーションが必要で、約80%と奏効率が高いといわれています。心室頻拍の急性期治療に対してベラパミルは有効ですが、慢性期管理としての経口ベラパミルは急性期ほど有効ではないとされています [27]。なお、アデノシン、リドカインなどは奏功しません [28]。
図6:Fascicular VT( [26]より引用)
いかがだったでしょうか?もちろん、大前提として持続性心室頻拍の90%以上に器質的心疾患(structural heart disease)があるとされていることを忘れてはいけません。器質的な異常が存在しないかどうかを評価するのが基本になります [29]。Fascicular VTは典型的な心電図が存在するため、様々な患者の対応をする救急医としては知っておくと幅が広がるものの一つです。迷った時に除細動を選択するのも問題ありませんし、専門診療科と相談できる環境であれば、相談しながら対応することも重要です。ただし、常に誰かに相談できるわけではありません。いつでも、そしてどこにいても目の前の患者に最善を尽くせるようにしたいですね。
Take home message:
1 不整脈が生じるメカニズムは3つ
2 「心室頻拍」と「変行伝導を伴う上室性頻拍」の鑑別ポイントは多彩
3 典型的なベラパミル感受性心室頻拍の特徴は意外とシンプル
引用文献:
1. 日本循環器学会, 日本不整脈心電学会.不整脈薬物治療ガイドライン. 2020年改訂版.
2. John E. Hall (著), 石川義弘(翻訳). ガイトン生理学 原著第13版. 医学書院, 2018.
3. Mangoni ME, Nargeot J. Genesis and regulation of the heart automaticity. Physiol Rev. 2008;88(3):919-982. .
4. Mankad P, Kalahasty G. Antiarrhythmic Drugs: Risks and Benefits. Med Clin North Am. 2019;103(5):821-834. .
5. 五十嵐 正男 (著), 山科 章 (著). 不整脈の診かたと治療 第5版. 医学書院. 1997.
6. Cronin EM, Bogun FM, Maury P, et al. 2019 HRS/EHRA/APHRS/LAHRS expert consensus statement on catheter ablation of ventricular arrhythmias: Executive summary. Heart Rhythm. 2020;17(1):e155-e205.
7. Al-Khatib SM, Stevenson WG, Ackerman MJ, et al. 2017 AHA/ACC/HRS guideline for management of patients with ventricular arrhythmias and the prevention of sudden cardiac death: Executive summary. : A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines and the Heart Rhythm Society. Heart Rhythm. 2018;15(10):e190-e252. .
8. Bloch Thomsen PE, Jons C, Raatikainen MJ, et al. Long-term recording of cardiac arrhythmias with an implantable cardiac monitor in patients with reduced ejection fraction after acute myocardial infarction. : the Cardiac Arrhythmias and Risk Stratification After Acute Myocardial Infarction (CARISMA) study. Circulation. 2010;122(13):1258-1264. .
9. Grimm W, Christ M, Bach J, Müller HH, Maisch B. Noninvasive arrhythmia risk stratification in idiopathic dilated cardiomyopathy: results of the Marburg Cardiomyopathy Study. Circulation. 2003;108(23):2883-2891. .
10. Katritsis DG, Zareba W, Camm AJ. Nonsustained ventricular tachycardia. J Am Coll Cardiol. 2012;60(20):1993-2004. .
11. Buxton AE, Duc J, Berger EE, Torres V. Nonsustained ventricular tachycardia. Cardiol Clin. 2000;18(2):327-viii. .
12. Killu AM, Stevenson WG. Ventricular tachycardia in the absence of structural heart disease. Heart. 2019;105(8):645-656. .
13. Kashou AH, Noseworthy PA, DeSimone CV, Deshmukh AJ, Asirvatham SJ, May AM. Wide Complex Tachycardia Differentiation: A Reappraisal of the State-of-the-Art. J Am Heart Assoc. 2020;9(11):e016598. .
14. De Ponti R, Bagliani G, Padeletti L, Natale A. General Approach to a Wide QRS Complex. Card Electrophysiol Clin. 2017;9(3):461-485. .
15. Vereckei A, Duray G, Szénási G, Altemose GT, Miller JM. Application of a new algorithm in the differential diagnosis of wide QRS complex tachycardia. Eur Heart J. 2007;28(5):589-600. .
16. Jastrzebski M, Sasaki K, Kukla P, Fijorek K, Stec S, Czarnecka D. The ventricular tachycardia score: a novel approach to electrocardiographic diagnosis of ventricular tachycardia. Europace. 2016;18(4):578-584. .
17. Kindwall KE, Brown J, Josephson ME. Electrocardiographic criteria for ventricular tachycardia in wide complex left bundle branch block morphology tachycardias. Am J Cardiol. 1988;61(15):1279-1283. .
18. Akhtar M, Shenasa M, Jazayeri M, Caceres J, Tchou PJ. Wide QRS complex tachycardia. Reappraisal of a common clinical problem. Ann Intern Med. 1988;109(11):905-912. .
19. Miller JM, Das MK, Yadav AV, Bhakta D, Nair G, Alberte C. Value of the 12-lead ECG in wide QRS tachycardia. Cardiol Clin. 2006;24(3):439-x. .
20. Barold SS, Stroobandt RX, Herweg B. Limitations of the negative concordance pattern in the diagnosis of broad QRS tachycardia. J Electrocardiol. 2012;45(6):733-735. .
21. Pava LF, Perafán P, Badiel M, et al. R-wave peak time at DII: a new criterion for differentiating between wide complex QRS tachycardias. Heart Rhythm. 2010;7(7):922-926. .
22. Vereckei A, Duray G, Szénási G, Altemose GT, Miller JM. Application of a new algorithm in the differential diagnosis of wide QRS complex tachycardia. Eur Heart J. 2007;28(5):589-600. .
23. Chen Q, Xu J, Gianni C, et al. Simple electrocardiographic criteria for rapid identification of wide QRS complex tachycardia: The new limb lead algorithm. Heart Rhythm. 2020;17(3):431-438. .
24. Griffith MJ, de Belder MA, Linker NJ, Ward DE, Camm AJ. Multivariate analysis to simplify the differential diagnosis of broad complex tachycardia. Br Heart J. 1991;66(2):166-174. .
25. Pachón M, Arias MA, Salvador-Montañés Ó, et al. A scoring algorithm for the accurate differential diagnosis of regular wide QRS complex tachycardia. Pacing Clin Electrophysiol. 2019;42(6):625-633. .
26. Nogami A, Komatsu Y, Talib AK, et al. Purkinje-Related Ventricular Tachycardia and Ventricular Fibrillation: Solved and Unsolved Questions [published online ahead of print, 2023 Jun 26]. JACC Clin Electrophysiol. 2023;S2405-500X(23)00356-0. .
27. Kapa S, Gaba P, DeSimone CV, Asirvatham SJ. Fascicular Ventricular Arrhythmias: Pathophysiologic Mechanisms, Anatomical Constructs, and Advances in Approaches to Management. Circ Arrhythm Electrophysiol. 2017;10(1):e002476. .
28. Sung R, Scheinman M. Spectrum of Fascicular Arrhythmias. Card Electrophysiol Clin. 2016;8(3):567-580. .
29. Siebels J, Kuck KH. Implantable cardioverter defibrillator compared with antiarrhythmic drug treatment in cardiac arrest survivors (the Cardiac Arrest Study Hamburg). Am Heart J. 1994;127(4 Pt 2):1139-1144. .